O cálculo do número de partículas atômicas é utilizado para indicar a quantidade de prótons (no núcleo), elétrons (na eletrosfera) e nêutrons (no núcleo) presentes em um átomo ou íon qualquer. Para realizá-lo, é fundamental conhecer algumas características dos átomos:
1- Número atômico (Z)
É um código matemático, representado pela letra Z maiúscula, posicionado no lado esquerdo inferior da sigla de um átomo:
ZX
Ele indica a quantidade de prótons (p) no núcleo e a quantidade de elétrons (e) na eletrosfera de um átomo. Assim, em termos gerais:
Z = p = e
2- Número de massa (A)
É um código matemático que corresponde à soma do número de prótons (p) e de nêutrons (n), ambos presentes no núcleo de um átomo qualquer. A equação que representa o número de massa é dada por:
A = p + n
Como o número de prótons é igual ao número atômico, podemos escrever a equação para calcular o número de massa da seguinte forma:
A = Z + n
Se conhecemos o número de massa e o número atômico de um átomo, podemos determinar o número de nêutrons da seguinte maneira:
n = A – Z
3- Íons
São átomos que perdem ou ganham elétrons. Apresentam um sinal positivo ou negativo posicionado na parte superior direita da sua representação, como no modelo a seguir:
X+ ou X-
-
Íon positivo: é denominado de cátion e o sinal positivo indica que ele perdeu elétrons.
-
Íon negativo: é denominado de ânion e o sinal negativo indica que ele ganhou elétrons.
a) Isótopos
Átomos que apresentam o mesmo número atômico e diferentes números de massa. Exemplo:
7X14 e 7Y16
Os átomos X e Y possuem mesmo número atômico (à esquerda da sigla), isto é, igual a 7. Já o átomo X possui número de massa (à direita da sigla) igual a 14, e o átomo Y apresenta número de massa igual a 16.
b) Isóbaros
Átomos que apresentam o mesmo número de massa e diferentes números atômicos. Exemplo:
15X31 e 13Y31
Os átomos X e Y possuem número de massa (à direita da sigla) igual a 31. Já o átomo X possui número atômico igual a 15, e o átomo Y apresenta número atômico igual a 13.
c) Isótonos
Átomos que apresentam diferentes números de massa e números atômicos, mas o mesmo número de nêutrons.
d) Isoeletrônicos
Átomos que apresentam o mesmo número de elétrons. Exemplo:
12X+2 e 7Y-3
O átomo X possui número atômico igual a 12 e é um cátion (com carga positiva +2), por isso, perde dois elétrons, tendo, então, 10 elétrons na sua eletrosfera. Já o átomo Y possui número atômico igual a 7 e é um ânion (com carga negativa -3), por isso, ganha três elétrons, tendo, então, 10 elétrons na sua eletrosfera.
Tópicos deste artigo
Mapa Mental: Partículas Atômicas
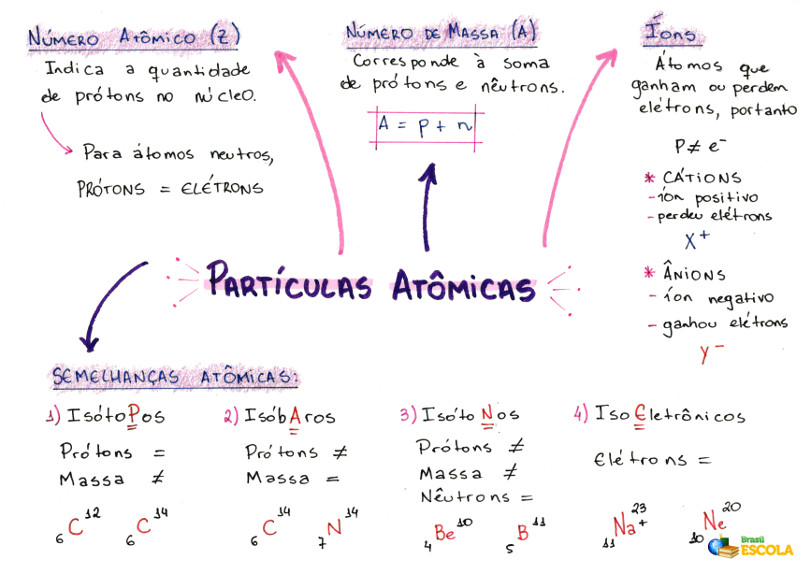
* Para baixar o mapa mental em PDF, clique aqui!
Exemplos do cálculo do número de partículas atômicas
Exemplo 1: Determine o número de prótons, nêutrons e elétrons do átomo 14X29.
Foram dados os seguintes valores referentes ao átomo X:
-
Número de massa (à direita superior) = 29
-
Número atômico (à esquerda inferior) = 14
-
Para determinar o número de prótons:
O número de prótons é sempre igual ao número atômico, por isso, o átomo X possui 14 prótons.
-
Para determinar o número de elétrons:
Como o átomo X não é um íon, logo, o número de elétrons é igual ao número de prótons, ou seja, 14.
-
Para determinar o número de nêutrons:
O número de nêutrons é determinado utilizando-se o número de massa e de prótons na fórmula a seguir:
A = p + n
29 = 14 + n
29 – 14 =n
n = 15
Exemplo 2: Determine o número de prótons, nêutrons e elétrons do íon X+3, sabendo que seu número de massa e número atômico são, respectivamente, 51 e 23.
Foram dados os seguintes valores referentes ao íon X:
-
Número de massa = 51
-
Número atômico (à esquerda inferior) = 23
-
Para determinar o número de prótons:
O número de prótons é sempre igual ao número atômico, por isso, o átomo X possui 23 prótons.
-
Para determinar o número de elétrons:
O íon X é positivo (+3), logo, é um cátion que perdeu três elétrons. Assim, seu número de elétrons é 20.
OBS.: A redução ou aumento do número de elétrons sempre ocorrem em relação ao número atômico.
-
Para determinar o número de nêutrons:
O número de nêutrons é determinado por meio do número de massa e de prótons na fórmula a seguir:
A = p + n
51 = 23 + n
51 – 23 =n
n = 28
Exemplo 3: Um átomo W possui número atômico e de massa iguais a, respectivamente, 29 e 57, sendo isóbaro de um átomo Y, que possui número atômico igual a 30, o qual é isótono de um átomo B, cujo número de massa é 65. Com essas informações, determine o número de prótons, nêutrons e elétrons do átomo B.
Dados fornecidos pelo exercício:
-
Átomo W
número atômico (à esquerda inferior) = 29
número de massa (à direita superior) = 57
Isóbaro de Y, ou seja, a massa de Y também é 57.
-
Átomo Y
número atômico = 30
número de massa = 57
Com esses dois valores, devemos determinar o seu número de nêutrons porque ele é isótono do elemento B:
A = Z + n
57 = 30 + n
57 – 30 = n
n = 27
-
Átomo B:
número de massa = 65
número de nêutrons = 27
Com esses dados, devemos determinar seu número atômico, pois, com isso, estaremos determinando seu número de prótons e seu número de elétrons (já que ele não é um íon):
A = Z + n
65 = Z +27
65 – 27 = Z
Z = 38
Logo, o átomo B apresenta 38 prótons, 38 elétrons e 27 nêutrons.
* Mapa Mental por Victor Ricardo Ferreira
Professor de Química
Por Me. Diogo Lopes Dias



 é, respectivamente:
é, respectivamente: